近日,南京农业大学动物科技学院刘红林教授团队在蛋白质乳酸化修饰调控生殖发育与细胞应激反应方面取得系列重要进展。团队在《Nucleic Acids Research》《Advanced Science》和《Cell Communication and Signaling》等期刊上,分别发表了题为“Lactylation of CREB is required for FSH-induced proliferation and
differentiation of ovarian granulosa cells”, “Lactylation
of HMGB1 at K177 Drives Nuclear Export of TlAR to Promote Hypoxia-lnduced
Stress Granule Formation”和 “Lactylation modification of
HlF-1a enhances its stability by blocking VHL recognition的研究论文。



受乳酸水平直接调控的蛋白质赖氨酸乳酸化修饰(Lysine Lactylation, Kla)被认为是一种新型代谢传感器,将细胞内的代谢信息与基因表达、应激适应等核心生命过程紧密相连,在基因表达调控、免疫应答及疾病发生中扮演着重要角色。刘红林教授团队经过研究,揭示了蛋白乳酸化修饰在FSH促卵泡颗粒细胞增殖、分化中的作用及机制,阐明了HMGB1乳酸化修饰调控低氧应激颗粒形成的分子机制,发现了乳酸化修饰调控HIF-1α稳定性的分子机制。
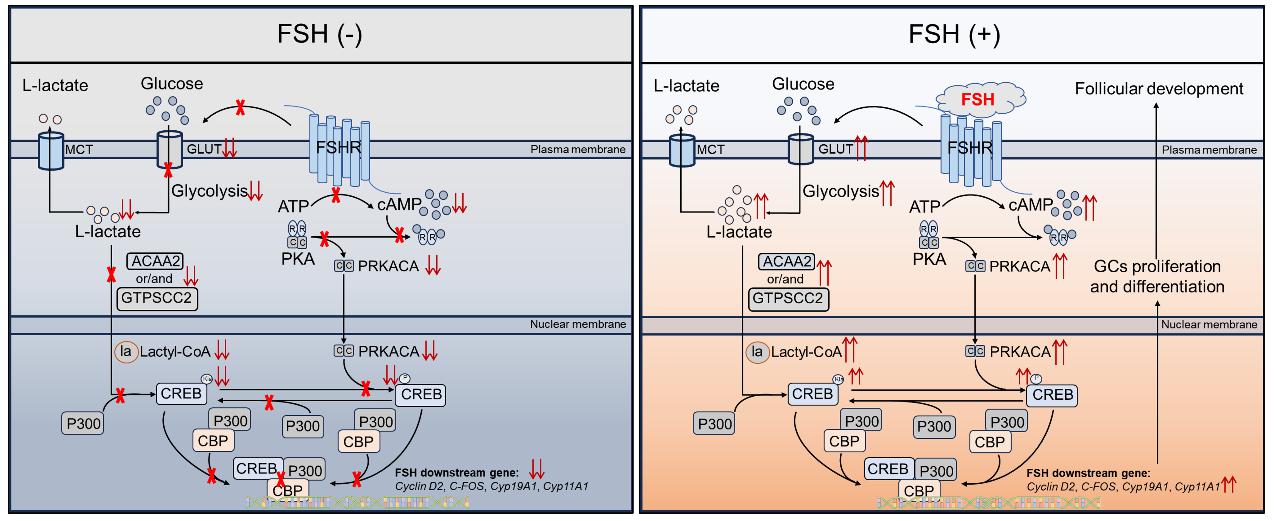
促卵泡素(FSH)是卵泡生长发育最为重要的调控因子,其通过与颗粒细胞膜上的G蛋白偶联受体FSHR结合,激活cAMP-PKA-CREB信号通路,进而促进颗粒细胞增殖与分化。研究发现,FSH对颗粒细胞的增殖与分化的促进作用依赖于乳酸生成与乳酸化修饰;抑制乳酸生成或阻断乳酸化修饰,均能抑制FSH诱导的颗粒细胞增殖与类固醇激素合成。
进一步研究发现,FSH信号通路下游的关键转录因子CREB K136位点存在乳酸化修饰,该位点的乳酸化修饰会促进其邻近位点Ser133磷酸化,激活CREB。FSH通过促进CREB乳酸化修饰诱导颗粒细胞增殖与分化。
研究揭示了FSH调控卵泡发育的新机制,并证明乳酸化修饰在cAMP第二信使信号通路中发挥重要作用。
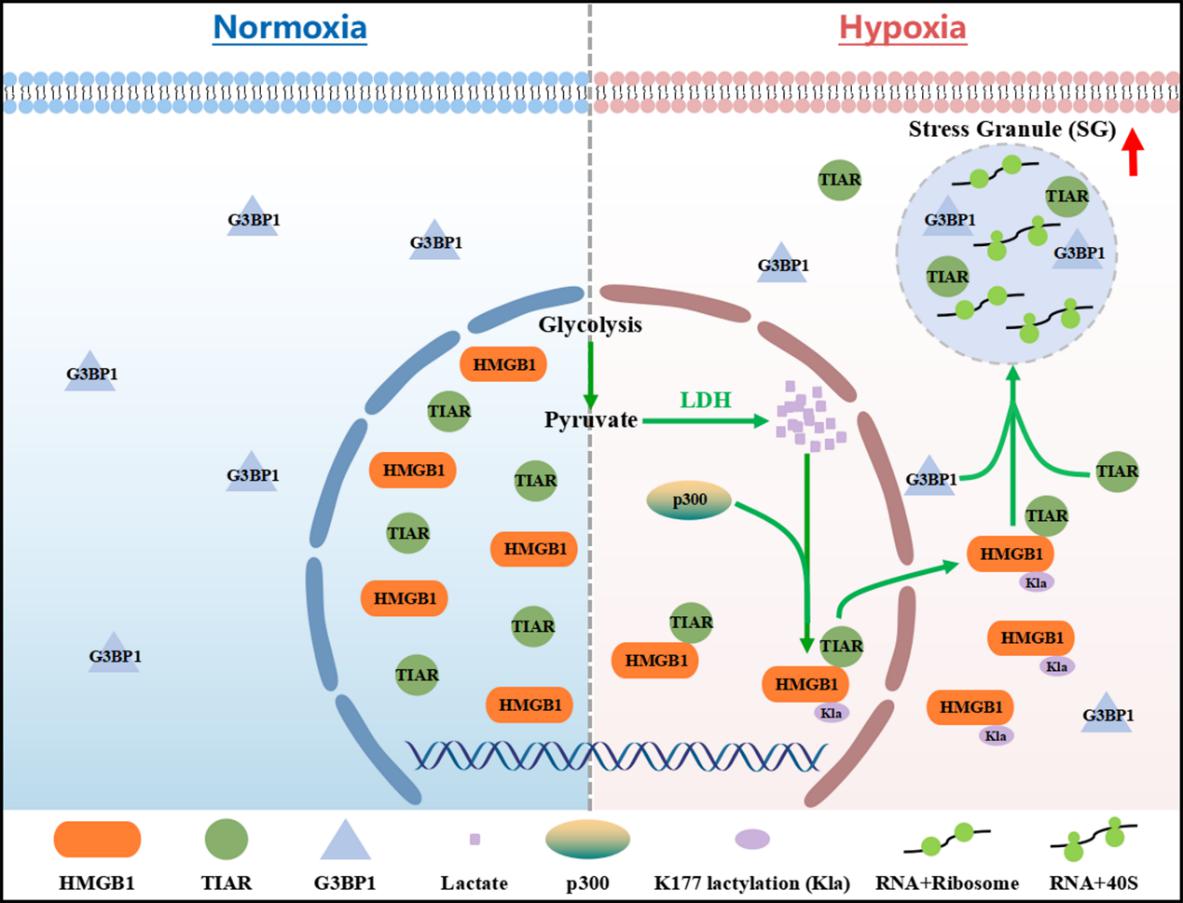
高迁移率族蛋白B1(HMGB1)是重要的核内蛋白,其核输出在炎症反应、细胞应激反应等生理病理过程中发挥重要作用。HMGB1的出核转运受到多种翻译后修饰的精密调控。研究发现,在低氧应激条件下,代谢产物乳酸能诱导HMGB1的K177位点发生乳酸化修饰,进而增强HMGB1与核输出受体CRM1的相互作用,驱动其核输出。这一发现确立了乳酸化修饰作为调控HMGB1出核的一种新机制。
进一步研究表明,乳酸化修饰介导的HMGB1核输出具有重要的生物学功能:HMGB1在核内与应激颗粒核心成分TIAR结合,协助其转运至细胞质,从而促进应激颗粒的组装。该研究创新性地揭示了乳酸化修饰在连接低氧代谢信号与细胞应激防御系统中的核心作用。
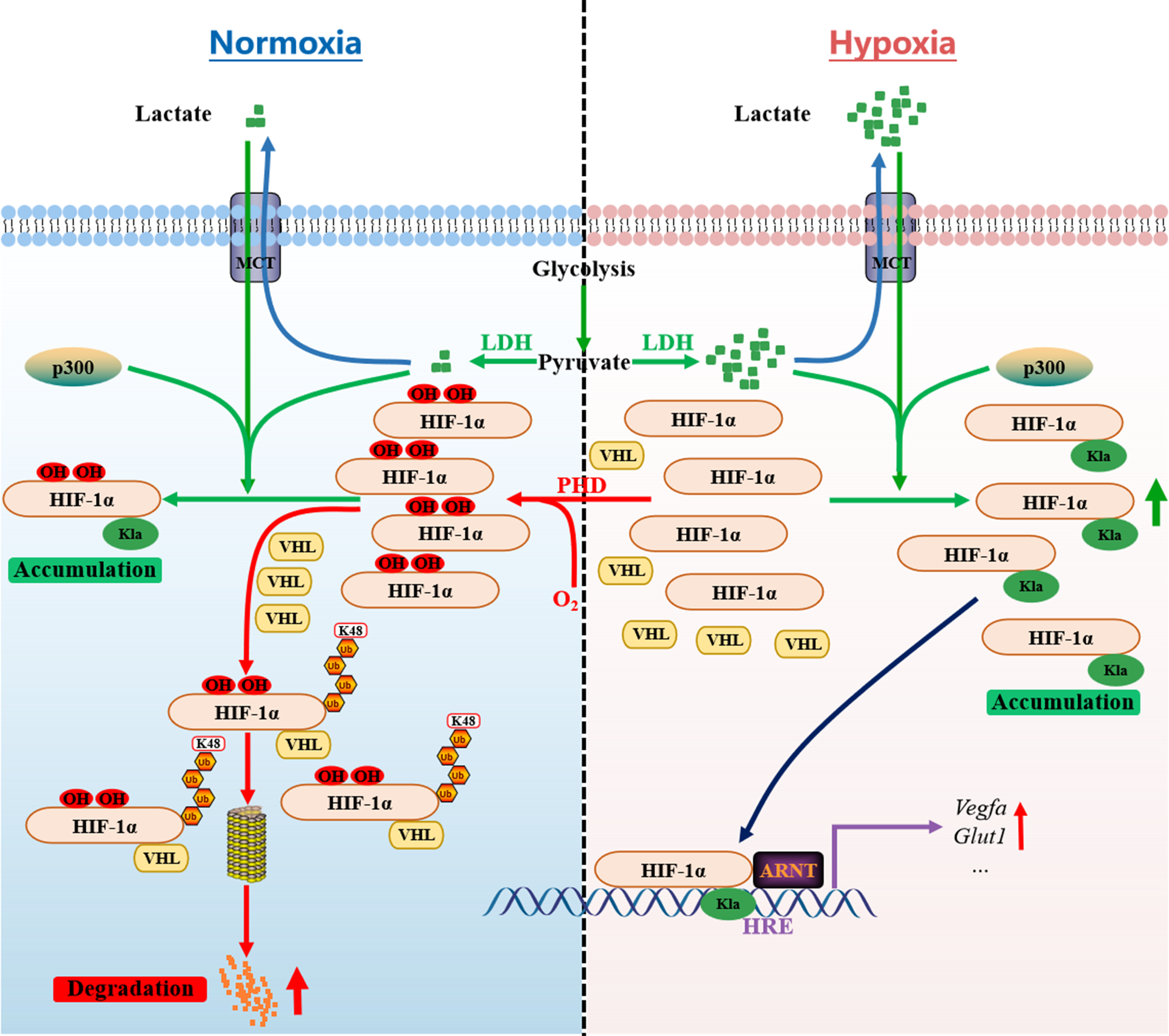
低氧诱导因子HIF-1α是细胞感知和应答低氧环境的核心调控因子,主要通过调节与低氧适应相关的基因表达,参与细胞的代谢调节、血管生成、细胞增殖及存活等生理过程。通常情况下,HIF-1α在常氧下被迅速降解,而在低氧条件下稳定存在。研究发现,常氧下添加乳酸能通过抑制HIF-1α降解来稳定其蛋白水平。此外,研究还发现乳酸化的HIF-1α具有更强的转录活性,能更有效地招募至靶基因(如Vegfa)启动子并激活转录。
进一步研究发现,HIF-1α的乳酸化修饰阻碍了E3泛素连接酶适配蛋白VHL对羟基化HIF-1α的识别和结合,进而抑制HIF-1α的泛素化降解。高精度质谱分析鉴定出小鼠通过K644位点而人和猪通过K12位点的乳酸化修饰发挥稳定HIF-1α的作用。
Nucleic Acids Research论文的第一作者为博士研究生吴刚,通讯作者为申明副教授与刘红林教授。Advanced Science论文的第一作者为李诚瑜博士和刘昭君博士,通讯作者为申明副教授和刘红林教授为共同通讯作者。Cell Communication and Signaling论文的第一作者为李诚瑜博士和伏晨硕士,通讯作者为申明副教授和刘红林教授。
上述研究得到了国家重点研发计划、国家自然科学基金、江苏省自然科学基金等项目的资助。
阅读次数:12
【 转载本网文章请注明出处 】





